Главная страница ● Основные положения ● Кислотно-щелочное состояние
глава 1.3.4.
Диагностика
Уже анамнез и изучение причин, вызвавших заболевание (эмфизема,
диабетическая кома), дают первые сведения о нарушениях в организме. Принимая во
внимание причины отклонений, можно предположить то или другое отклонение.
Вид и степень изменений полностью разъясняют лабораторные данные. Они
необходимы для точного и окончательного диагноза и терапии, поскольку
клиническая картина отдельных нарушений нехарактерна.
Основные параметры содержания кислот и оснований
1. Парциальное давление углекислого газа в артериальной крови (рСО2), масштаб
колебаний, обусловленных дыханием.
2. Избыток/недостаток оснований:
масштаб колебаний, обусловленных метаболизмом, основа расчетов для терапии.
3. Значение рН крови:
величина концентрации ионов водорода.
По этим трем данным можно поставить общий диагноз, оценить тяжесть состояния и
его компенсацию и, кроме того, определить способ лечения.
Направленная терапия связана с точным диагнозом. Эмпирическое лечение связано с
риском и может повести к серьезным последствиям. В каждой больнице необходимо
иметь условия для определения этих величин. Если это невозможно, то следует
использовать простую схему лечения. Современная диагностика предполагает
быстродействующую аппаратуру (рис. 15). Без лабораторных данных ошибки и
неудовлетворительное лечение неизбежны.
Значение рН (водородный потенциал)
Значение рН является выражением концентрации ионов водорода*
Для понимания рН служат следующие теоретические рассуждения: вода диссоциирует
по следующей упрощенной формуле:
Н2О=Н++ОН—

Рис. 15. Набор приборов для определения кислотно-щелочного состояния.
Степень диссоциации при этом очень незначительна. В 10000000 л воды при 25 °С
находится только 1 экв (1,008 г) диссоциированных ионов водорода. При этом 1 л
воды содержит 0,000000 1 экв Н+=10—7 экв Н+. Для упрощения Sorensen (1909) ввел
понятие рН.
Значение рН — это отрицательный десятичный логарифм концентрации ионов водорода
в экв/л
Пример: [Н+] = 10—7 экв/л, рН = —lgl0—7 = 7,0
С 1924 г. Sorensen заменил значение рН на «действительную концентрацию ионов
водорода, на активность ионов водорода.
В англо-американской литературе концентрация ионов водорода часто дается не в
значениях рН, а в мэкв/л, как соответствующая единица концентрации всех катионов
и анионов (табл. 5).
Такое обозначение концентрации ионов водорода в отличие от рН имеет важное
преимущество, так как оно находится в единой системе выражения катионов и
анионов. Для широкого круга читателей можно сказать, что концентрации ионов
водорода в плазме существуют в той же величине, как и свободный тироксин.
Значения в норме
7,40 (7,35—7,45) — артериальная кровь (Weisberg)
Таблица 5. Сравнение значений рН и концентрации ионов водорода в экв, мэкв и
нэкв на литр
|
Значение рН |
Концентрация ионов водорода |
||
|
экв/л |
1 мэкв/л |
1 нэкв/л |
|
|
6,80 |
0,000000158 |
0,000158 |
158 |
|
7,00 |
0,000000100 |
0,000100 |
100 |
|
7,35 |
0,000000045 |
0,000045 |
45 |
|
7,40 |
0,000000040 |
0,000040 |
40 |
|
7,44 |
0,000000036 |
0,000036 |
36 |
|
7,80 |
0,000000016 |
0,000016 |
16 |
7,57 (7,32 — 7,42) — венозная кровь (Weisberg)
6,80—7,00 — внутриклеточное значение рН (Lawin)
У здоровых в состоянии покоя значения рН капиллярной и артериальной крови почти
совпадают (Gambino).
Значение рН зависит от температуры; оно повышается при понижении температуры.
Если температура отклоняется от 37 °С, то необходимо проводить коррекцию рН
(Heisler, Schorer).
Парциальное давление углекислого газа (рСО2)
Значение рСO2 парциальное давление углекислого газа является мерой
недиссоциированной угольной кислоты. Она существует в гидролиза ванном — Н2СО3 и
негидролизо ванном — СО2 состоянии.
(0,03 — молярный коэффициент растворимости углекислого газа в воде; он зависит
от темлературы). Отклонения реальной температуры от эталонной должны
корректироваться (Heisler, Schorer). При снижении температуры величина рСО2
падает.
Значения в норме
40 (от 34 до 46) мм рт. ст. — артериальная кровь (Weisberg) 46 (от 42 до 55) мм
рт. ст. — венозная кровь (Weisberg)
Избыток/дефицит оснований
Избыток/дефицит оснований означает избыток оснований или недостаток оснований =
избыток нелетучих кислот в изучаемой пробе крови в мэкв/л крови или плазмы.
Для разъяснения служит следующая мысленная модель.
Поместим, например, в 1 л крови 10 мл 1 н. раствора соляной кислоты (10 мэкв).
Образуется дефицит оснований — 10. Этот дефицит оснований можно измерить простым
титрованием до рН 7,40 (при рСО2 40 мм рт. ст. и 37 °С), на что потребуется 10
мэкв основания.
Поэтому можно сказать:
избыток/дефицит оснований соответствует избытку основания или кислоты
(недостаток оснований), который обнаруживается титрованием сильной кислотой или
основанием до значения рН 7,40 при рСО2 40 мм рт. ст. и 37 °С.
Из кислот принимаются во внимание только нелетучие (см. определение). Угольная
кислота категорически исключается. Избыток/дефицит оснований отражает только
метаболические нарушения.
Еще нужно отметить, что избыток оснований обозначают как + (плюс), избыток
оснований и дефицит оснований как— (минус). Знание этих обозначений важно для
понимания некоторых формул и номограмм Sigaard—Andersen (рис. 16, 17).
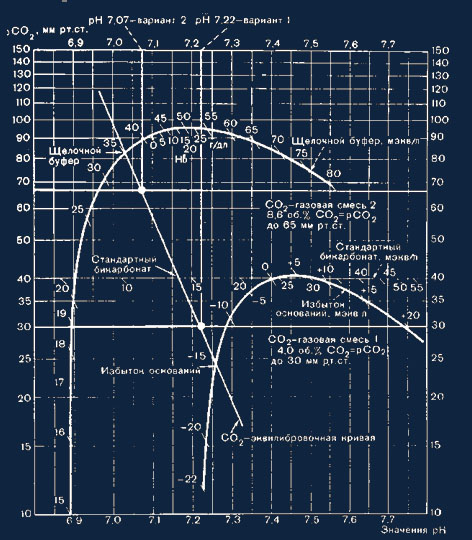
Рис. 16. Номограмма рН — lg pC02 no Siggaard — Andersen для вычисления
параметров кислотно-щелочного состояния на основе средних значений рН.
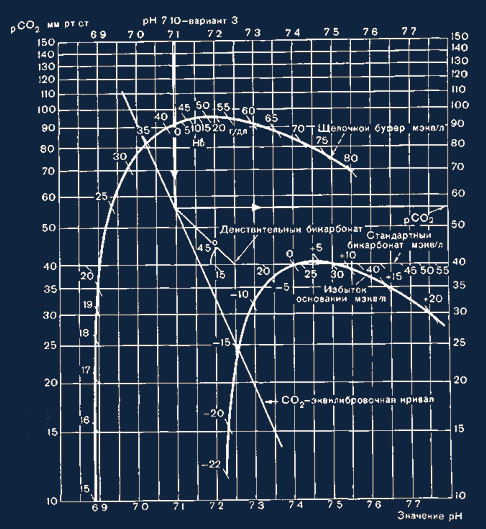
Рис. 17. Определение значении рСО2 и действительной концентрации бикарбоната.
Избыток/дефицит оснований является точной мерой существующего метаболического
нарушения. При этом нужно учесть, что увеличивающиеся количества кислоты или
основания забуфериваются не только системой угольная кислота/гидрокарбонат, но
и другими буферными системами крови (белки, гемоглобин, фосфаты). По
концентрации гидрокарбоната нельзя непосредственно судить об избытке или
Дефиците основания. Только отклонение оснований служит точной исходной расчетной
величиной для дозировки корригирующего раствора. Избыток/дефицит оснований
наиболее просто обнаруживается по методу Astrup (см. рис. 15).
Определение избытка/дефицита основания (ИО/ДО) вытекает из реального насыщения
крови кислородом. По методу Asrtup определение проводится в крови, насыщенной
кислородом, и для получения точных данных необходима коррекция:
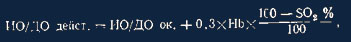
где ДО/ИО в мэкв/л; НЬ = гемоглобин в г/100 мл; SO2 = процентное действительное
насыщение кислородом; ИО/ДО дейст-ИО/ДО в действительности; ИО/ДОок = НО/ДО при
полном насыщении кислородом.
Количественные соотношения в крови эритроцитов и плазмы не играют никакой роли
в отклонении оснований, выра жаясь по-иному, избыток/дефицит оснований в
эритроцитах соответствует таковому в плазме (ИО/ДО клеток = ИО/ДО плазмы; см.
конструкцию кривых избытка оснований, рис. 18). В связи с этим вычисляют ИО/ДО в
мэкв/л как крови, так и плазмы. Аналогично для всех буферных оснований (Неisler,
Schorer).
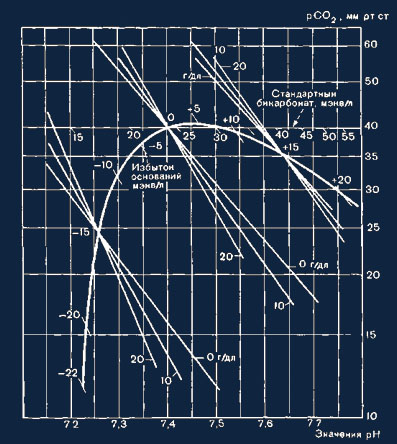
Рис. 18. Построение кривой избытка оснований. Можно к пробе крови дс бавить
определенное количество сильных кислот (или оснований) и пос этого получить
эквилибровочную кривую СО2, а также составить диаграмму рН — lg pCO2 (см. рис.
16). Если взять то же количество кислоты при другой концентрации гемоглобина, то
подъем кривой меняется. Точки пересечения кривых с одинаковыми отклонениями
оснований, но различной кон-центрацией гемоглобина постоянно находятся на кривой
избытка оснований. Путем добавления различных количеств кислот или оснований
можно произвольно определить любые точки пересечения. Таким образом
конструируется кривая.
Пограничные значения —2,3 до +2,3 мэкв/л
Избыток оснований (величина положительная) имеет место:
— при метаболическом алкалозе;
— в качестве выражения компенсации дыхательного ацидоза.
Дефицит оснований (величина отрицательная) имеет место:
— при метаболическом ацидозе;
— в качестве выражения компенсации дыхательного алкалоза.
Стандартный гидрокарбонат
Стандартному гидрокарбонату соответствует концентрация гидрокарбоната в плазме
изучаемой пробы крови в мэкв/л при стандартных условиях (рСО2 40 мм рт. ст.,
полное насыщение гемоглобина кислородом, 37 °С).
Стандартный гидрокарбонат отражает только метаболические влияния, так как
влияние дыхания при определении стандартного гидрокарбоната исключается (рСО2 40
мм рт.).
Снижение стандартного гидрокарбоната соответствует метаболическому ацидозу,
повышение — метаболическому алкалозу. Отклонения служат выражением компенсации
дыхательных нарушений. При дыхательном ацидозе повышается концентрация
гидрокарбоната, при дыхательном алкалозе она падает.
Если допустить концентрацию гидрокарбоната как оценц, метаболических влияний на
содержание кислот и оснований, то она не будет точной мерой дозировки
корригирующих растворов, так как буферную емкость негидрокарбонатных буферных
оснований нельзя принимать во внимание.
Практически можно использовать следующие соотношения ИО/ДО и стандартного
гидрокарбоната для проведения терапии:
ИО/ДО=(А—В)-1,2, где А — стандартный гидрокарбонат — лабораторные данные
(мэкв/л); В — стандартный гидрокарбонат — нормальное значение (мэкв/л).
Значения в норме
24 мэкв/л (22—26) артериальная кровь (Geigy)
26 мэкв/л (24—28) венозная кровь (Geigy)
Действительная концентрация гидрокарбоната
Действительной концентрации гидрокарбоната соответствует концентрация
гидрокарбоната в плазме изучаемой пробы крови при действительных значениях рН и
рСO2 и действительном насыщении кислорода в мэкв/л.
Она может быть рассчитана из уравнения Henderson— Hasselbalch или по номограмме
Siggaard — Andersen (рис. 17). На действительную концентрацию гидрокарбоната
действуют как дыхательные, так и метаболические влияния.
Общие буферные основания
Понятию общих буферных оснований соответствует сумма всех буферных анионов
изучаемой пробы крови, как ионы гидрокарбоната, фосфата, так и буферная емкость
белков и гемоглобина при 37 °С и парциальном давлении углекислого газа 40 мм рт.
ст. в мэкв/л крови.
Общие буферные основания можно определять для восстановления и полностью
оксигенированной крови. По методу Astrup общие буферные основания исследуют в
крови, полностью насыщенной кислородом.
Нормальное значение общих буферных оснований зависит от концентрации
гемоглобина. При значениях pH 7,40 и рСО2 40 мм рт. ст. различные концентрации
гемоглобина систематизированы (табл. 6). Полученная в результате зависимость
имеет вид (Morgan):
Таблица 6. Нормальные значения общих буферных оснований при различных
концентрациях гемоглобина (Morgan)
|
Концентрация гемоглобина, г/дл |
Общие буферные основания — нормальные значения, мэкв/л |
|
8 |
45 |
|
13 |
47 |
|
15 |
48 |
|
20 |
50 |
Общая концентрация буферных оснований = 41,7 + 0,42 х Нb (г/дл).
Буферные основания, так же как ИО/ДО, показывают накопление нелетучих кислот
или оснований. При увеличении кислот уменыпаются общие буферные основания.
Связь между ИО/ДО и общими основаниями можно сформулировать следующим образом:
Избыток оснований (+) J = общие буферные основания
(измеряемое Дефицит оснований ( —) / значение) —
— Общие буферные основания (нормальное значение)
По этой формуле можно также проверить точность лабораторных измерений: к
измеренному значению общих буферных оснований прибавляют дефицит оснований (при
избытке оснований эту величину вычитают из значения общих буферных оснований).
Нормальное значение общих буфер-ных оснований по этому методу переносят на
кривую номограммы Siggaard—Andersen. Так как нормальное значение общих буферных
оснований зависит от концентрации гемоглобина, то каждому указанному там
значению соответствует определенная концентрация гемоглобина (см. рис. 16).
Величины концентраций гемоглобина, определяемые по номограмме и лабораторными
методами, не должны отличаться друг от друга более чем на ±3 г/дл.
Методы измерения
Искомое значение определяют по ряду измерений рН (см. рис. 15), в первую очередь
взятого образца крови. Через пробу крови пропускают газовые смеси, состоящие из
кислорода и углекислого газа, первая из которых содержит 3—4 об.% углекислого
газа, а вторая 8—9 об.%. После этого измеряют рН в пробах крови (значение рН = 1
и значение рН = 2). Кроме того, в третьей пробе измеряют действительное
значение рН (значение рН = 3). Измеренные значения рН и рСО2 использованных
газовых смесей наносят на номограмму (см. рис. 16). Точки пересечения
измеренных значений рН=1 и рН = 2 соединяют с значениями рСО2 1 и 2.
Построенная таким методом кривая обозначается как равновесная кривая СО2. С ее
помощью можно обнаруживать как отклонение оснований, буферных оснований и
стандартного гидрокарбоната (см. рис. 16), так и действительное значение рСО2 и
действительную концентрацию гидрокарбоната (см. рис. 17). Построение кривой
избытка оснований см. рис. 18.
|
● |
● |
● |
● |
● |
● |
● |
● |
copyright©surgerycom